Proprietà chimiche degli elementi del gruppo 2 e del gruppo 7 (17)
- CHIMICA
- 17 Anni
- Supplemento avanzato (AS)
- 4 ore e 20 minuti
Area delle scienze:
Classe:
Età degli studenti:
Tempo complessivo:
Tempo di preparazione
Tempo d’insegnamento
Metodologia didattica da usare:
L’insegnamento sarà sia pratico che basato sulla flipped classroom, gli studenti riceveranno collegamenti video con domande esplorative per prepararsi all’estesa attività pratica, che comprende 4 lezioni. La lezione si svolgerà in modo pratico, tuttavia lo student deve comprendere ed esaustivamente rispondere alle domande prima di iniziare l’indagine pratica.
Concetti chiave:
Struttura atomica e come le proprietà chimiche degli elementi dipendono dalla suddetta, e in particolare dalla disposizione degli elettroni intorno al nucleo.
Gli studenti considerano in dettaglio le tendenze e le reazioni degli elementi del gruppo VII. Queste attività pratiche permettono agli studenti di sviluppare le importanti tecniche quantitative. Comprendendo anche test analitici, gli studenti ottengono esperienza in abilità pratiche qualitative come l’osservazione.
Panoramica
Svolgi le attività relative alla chimica di gruppo e discuti le somiglianze e le differenze nelle proprietà chimiche dei gruppi 2 e 7.
Missione dello studente
Sei uno scienziato che lavora in un laboratorio forense, campioni di materiali inorganici sconosciuti sono stati raccolti da un magazzino di una fabbrica dopo essere andato a fuoco. Gli investigatori della polizia pensano che l’incendio sia doloso e a te è stato assegnato il compito dell’analisi. Devi determinare quali sono i materiali sconosciuti, basandoti sulla loro reattività. Sei responsabile dell’analisi dei materiali.
Il tuo compito è: Determinare la reattività chimica dei materiali sconosciuti.
Skill tecniche del 21esimo secolo ottenute tramite quest’attività
Elenco delle competenze:
- Risoluzione dei problemi,
- Analisi pratica,
- Pensiero critico,
- Trarre conclusioni basate sui fatti,
Apprendimento basato sull’indagine.
Posizioni lavorative correlate
Scienziato forense Investigatore forense Analista chimico
Strategie di diversificazione per soddisfare diverse esigenze didattiche
Tutoraggio tra pari, compiti pratici con supporto, formazione e inquadramento delle domande.
Tempo necessario per completare la lezione
Quattro lezioni di 45 minuti (Se le vostre lezioni sono più brevi o più lunghe, potete spezzare questa sequenza in più lezioni o meno).
Risultati didattici attesi
Gruppo 2: Metalli
- Conoscere l’aspetto degli elementi del gruppo 2 e sapere che i metalli più in basso nel gruppo devono essere conservati in olio.
- Conoscere, inoltre, le loro proprietà fisiche e chimiche elencate nella tabella sottostante.
- Sapere che i test alla fiamma sono utilizzati per identificare i cationi metallici e per dimostare l’esistenza dei gusci elettronici.
| Proprietà fisiche | Proprietà chimiche |
| Sappiate che sono buoni conduttori di elettricità.
Sappiate che hanno basse densità.
Sappiate che hanno superfici grigie e lucide quando sono appena tagliate con un coltello. |
Sappiate che sono metalli molto reattivi.
Sappiate che formano composti ionici con i non-metalli. |
Gruppo 7 (17): Alogeni
Conoscere le tendenze nella reattività degli alogeni che possono essere spiegate dalla loro disponibilità ad accettare elettroni da altre specie.
Conoscenze e vocabolario precedente
Tendenze del raggio atomico, tendenze dell’energia di ionizzazione, gruppi e periodi, carica nucleare.
Pratiche di scienza e ingegneria/matematica
Fornire agli studenti la stampa del modello di Inchiesta Scientifica e il modello Test Your Idea per aiutarli con la loro domanda investigativa. Vedere gli allegati I. e II.
Allineamento del curriculum
Metalli del gruppo 2
CCEA GCE Chemistry:
Unità AS 1: Concetti di base in chimica fisica e inorganica
- Test qualitativi:
- Utilizzare i test di catione, tra cui:
- Test alla fiamma per identificare gli ioni metallici Li+, Na+, K+, Ca2+, Ba2+ e Cu2+
- Utilizzare i test di catione, tra cui:
Unità AS 2: ulteriore chimica fisica e inorganica e introduzione alla chimica organica
- Elementi del gruppo II e loro composti
- Spiega perché questi sono considerati elementi del blocco s;
- Studiare e descrivere le reazioni degli elementi con ossigeno, acqua e acidi diluiti;
- Descrivere la natura basica degli ossidi e le loro reazioni con l’acqua e gli acidi diluiti;
I risultati dell’apprendimento sono allineati al curriculum di cui sopra.
Conoscere l’aspetto degli elementi del gruppo 2 e sapere che i metalli più in basso nel gruppo devono essere conservati in olio.
Conoscere, inoltre, le loro proprietà fisiche e chimiche elencate nella tabella sottostante.
| Proprietà fisiche | Proprietà chimiche |
| Sappiate che sono buoni conduttori di elettricità.
Sappiate che hanno basse densità.
Sappiate che hanno superfici grigie e lucide quando sono appena tagliate con un coltello. |
Sappiate che sono metalli molto reattivi.
Sappiate che formano composti ionici con i non-metalli. |
Gruppo 7 (17): Alogeni
Conoscere le tendenze nella reattività degli alogeni che possono essere spiegate dalla loro disponibilità ad accettare elettroni da altre specie.
Questo risultato di apprendimento è allineato al curriculum CCEA GCE Chemistry:
Unità AS 1: Concetti di base in chimica fisica e inorganica
1.8 Alogeni
1.8.5 Descrivere l’andamento della capacità ossidante degli alogeni lungo il gruppo applicato alle reazioni di spostamento degli alogeni con altri ioni alogenuri in soluzione;
1.10 Test qualitativi
1.10.4: Aggiunta di una soluzione acidificata di nitrato d’argento per distinguere tra cloruro, bromuro e ioduro (seguita dall’aggiunta di una soluzione di ammoniaca diluita e concentrata)
Lezione
Impegnarsi: L’insegnante aiuta gli studenti a riflettere su ciò che già sanno e a identificare eventuali lacune di conoscenza. E’ importante stimolare l’interesse per i concetti futuri in modo che gli studenti siano pronti ad imparare. Gli insegnanti potrebbero incaricare gli studenti di fare domande iniziali o di scrivere ciò che già sanno sull’argomento. Questo è anche il momento in cui il concetto viene introdotto agli studenti per la prima volta.
Gli studenti ricevono questi link video prima della lezione, secondo la strategia della flipped classroom utilizzata. Gli studenti guarderanno i video a casa, risponderanno alle domande relative ai video. Formuleranno anche le proprie domande e idee, quindi esploreranno le indagini pratiche, che hanno osservato e faranno domande all’insegnante mentre rispondono alla serie di domande che sono state date loro in precedenza. L’idea di fare e rispondere alle domande, formulare idee darà agli studenti una migliore comprensione delle attività pratiche che svolgeranno. Una volta eseguite le attività pratiche, gli studenti dovranno fare inferenze basate sui risultati per confrontarle con le ipotesi che hanno scritto prima degli esperimenti.
Materiali: Link al video, appunti con domande incorporate
Prima della 1a lezione:
- Reattività dei metalli del gruppo 2: https://www.youtube.com/watch? app=desktop& v=O6DaCYKh77E
- Terre alcaline – Gruppo 2 Proprietà:
https://www. youtube. com/watch? app=desktop& v=dKCHnuEdVY8
- Reazioni di alogeni con ioni alogenuri: https://www. youtube. com/watch? v=HW2jRyQ3dzo.
Prima della 2a lezione:
- Tavola periodica: Metalli alcalini terrestri e alogeni:
https://www.youtube.com/watch? app=desktop& v=sxCCFNkGcW0
Prima della 3a lezione:
- Reazione del cloro con il magnesio:
https://www. youtube. com/watch? app=desktop& v=IIH0M0eoDhE
Prima della 4a lezione:
- Gruppo 7 – Gli alogeni: https://www. youtube. com/watch? v=J7b2aBKa6-U
- Alogenuri in soluzione: Test con nitrato d’argento acidificato:
https://www. youtube. com/watch? app=desktop& v=7F4JhrBWdY4
Preparazione prima di ogni lezione: [ 20] Minuti per preparare il laboratorio per gli esperimenti
Facilitazione dell’esperienza di apprendimento: [10 ] Minuti
Transizione: [ 2] Minuti
L’insegnante: condurrà le sessioni di domande e risposte, spiegherà i concetti all’inizio di ciascuna delle 4 lezioni
Gli studenti: ascolteranno attentamente, prenderanno appunti e faranno domande
Esplorare: Durante la fase di esplorazione, gli studenti esplorano attivamente il nuovo concetto attraverso esperienze di apprendimento concrete. Potrebbe essere chiesto loro di seguire il metodo scientifico e di comunicare con i loro compagni per fare delle osservazioni. Questa fase permette agli studenti di imparare in modo pratico.
Materiali: Attrezzatura pratica e analiti chimici
Facilitazione dell’esperienza di apprendimento: [30] Minuti
L’insegnante: Facilita la classe pratica, dà istruzioni agli studenti e li rende consapevoli della salute e della sicurezza per quanto riguarda le loro attività:
- 1a lezione: Test della fiamma – attività in laboratorio
- 2a lezione: Guarda le caratteristiche fisiche dei metalli del gruppo 2 e quanto sono reattivi – attività in laboratorio
- 3a lezione: Reazioni con elementi del gruppo 2 e del gruppo 7 – attività in laboratorio
- 4a lezione: Reazioni di spostamento degli alogeni con altri ioni alogenuri in soluzione e aggiunta di soluzione di nitrato d’argento acidificato per distinguere tra cloruro, bromuro e ioduro (seguita dall’aggiunta di soluzione di ammoniaca diluita e concentrata) – attività in laboratorio
Gli studenti: Eseguiranno le loro pratiche in modo sicuro e accurato, leggeranno le istruzioni e le comprenderanno prima di iniziare le attività.
Spiegare: Questa è una fase guidata dall’insegnante che aiuta gli studenti a sintetizzare le nuove conoscenze e a fare domande se hanno bisogno di ulteriori chiarimenti. Affinché la fase di spiegazione sia efficace, gli insegnanti dovrebbero chiedere agli studenti di condividere ciò che hanno imparato durante la fase di esplorazione prima di introdurre informazioni tecniche in modo più diretto, secondo “The 5E Instructional Model: A Learning Cycle Approach for Inquiry-Based Science Teaching”. Questo è anche il momento in cui gli insegnanti utilizzano video, software per computer o altri aiuti per aumentare la comprensione.
Se gli studenti hanno difficoltà a svolgere una qualsiasi delle attività, l’insegnante spiegherà ulteriormente e potrà affrontare la difficoltà durante l’attività.
Materiali: attrezzature di laboratorio per supportare ulteriori spiegazioni
Preparazione: [ 0] Minuti
Facilitazione dell’esperienza di apprendimento: [5 – 10 ] Minuti
Transizione: [ 0] Minuti
L’insegnante: spiegherà ulteriormente il concetto o la tecnica da applicare in laboratorio
Gli studenti: ascolteranno con attenzione e applicheranno le conoscenze
Elaborare: La fase di elaborazione del Modello 5E si concentra sul dare agli studenti lo spazio per applicare ciò che hanno imparato. Questo li aiuta a sviluppare una comprensione più profonda. Gli insegnanti possono chiedere agli studenti di creare presentazioni o condurre ulteriori indagini per rafforzare le nuove competenze. Questa fase permette agli studenti di consolidare le loro conoscenze prima della valutazione.
Dopo ogni lezione, agli studenti viene chiesto di lavorare in gruppo e di ricercare l’argomento in modo più dettagliato. Prepareranno poi una presentazione come compito a casa, e insegneranno alla classe un aspetto diverso della pratica.
Materiali: Software Power Point, appunti degli studenti
Preparazione: Circa [60 ] minuti per gli studenti per effettuare la ricerca e preparare le diapositive
Facilitazione dell’esperienza di apprendimento: [ 10] Minuti per gruppo per presentare la loro lezione
Transizione: [ 0] Minuti
L’insegnante: Valutare una presentazione fatta dagli studenti su ciò che hanno trovato dopo l’analisi pratica.
Gli studenti: Presenteranno all’insegnante e risponderanno a domande pertinenti da parte dell’insegnante per valutare il loro livello di comprensione.
Valutare: Il Modello 5E permette una valutazione sia formale che informale. Durante questa fase, gli insegnanti possono osservare i loro studenti e vedere se hanno una comprensione completa dei concetti fondamentali. E’ anche utile notare se gli studenti affrontano i problemi in modo diverso in base a ciò che hanno imparato. Altri elementi utili della fase di valutazione includono l’autovalutazione, la valutazione tra pari, i compiti di scrittura e gli esami.
Agli studenti vengono dati appunti con domande post attività e link web a siti di chimica per estendere la comprensione degli argomenti pratici.
L’interrogazione post-attività potrebbe essere lasciata alla classe successiva se il tempo a disposizione si esaurisce durante la sessione pratica.
Gli studenti possono anche ricevere un test OPPURE compiti a tempo.
Materiali: Test o compiti a tempo
Preparazione: [ 10 ] Minuti
Facilitazione dell’esperienza di apprendimento: [5] Minuti per fornire agli studenti appunti e domande post attività.
[45 -60 ] Minuti per un test o compiti a tempo O
Transizione: [ 0 ] Minuti
L’insegnante: indirizzerà gli studenti alle risorse per migliorare la loro comprensione OPPURE presenterà agli studenti una valutazione a tempo basata sulle loro scoperte
Gli studenti: completeranno le domande incorporate dopo aver visto i link video forniti dall’insegnante OPPURE risponderanno alle domande nel modo più completo possibile nel tempo assegnato.
Compiti di apprendimento indipendenti (ILT): Fornire due-tre sfide agli studenti da completare prima della lezione successiva.
- Gli studenti guarderanno i link video dati loro dall’insegnante per migliorare le loro conoscenze.
- Gli studenti cercheranno applicazioni nella vita reale di ciò che hanno imparato in
- Gli studenti risponderanno alle domande dopo la lezione
- Gli studenti lavoreranno in gruppi per preparare le presentazioni e presentarle alla loro classe
Feedback dello studente
Gli studenti riceveranno un feedback individuale in modo tempestivo. Il feedback farà riferimento ai risultati delle competenze che la valutazione è stata progettata per testare e se lo studente ha soddisfatto tali risultati. Il suddetto prenderà in considerazione anche il feedback dello studente su come ha trovato la lezione.
Tracciamento dei risultati ottenuti
La conoscenza acquisita in questa lezione può essere mappata rispetto alla struttura atomica nella Fisica AS/A2, i ruoli dei metalli biodisponibili nella biologia AS/A2, ed il legame degli alogeni nelle molecole biologiche.
Valutazione
Pratica, presentazione degli studenti, valutazione a tempo e domande e risposte.
Materiali
Questo piano di lezione sarà accompagnato da un’istruzione pratica completa per le lezioni, di seguito è solo un riassunto.
Composti alogeni fluoruro, cloruro, bromuro e ioduro
Cloruro di sodio
Bromuro di sodio
Ioduro di sodio
Soluzione di ammoniaca diluita e concentrata Provette
Portaprovette Pinzette di metallo
Bacinella d’acqua Becci di Bunsen
Sostegno per buretta con pinze
Nitrato d’argento Bromuro di sodio Ioduro di sodio Acido nitrico diluito
Ansa a filo di nichelcromo
Acido cloridrico diluito Li+, Na+, K+, Ca2+, Ba2+ e Cu2+ (sali metallici)
Acqua distillata
Acqua di cloro Acqua di bromo Acqua di iodio Fluoruro d’argento Cloruro d’argento Bromo d’argento Ioduro d’argento Ammoniaca Metalli del gruppo 2
Cappe a fumo Occhiali da vista Camici da laboratorio
Guanti
Preparazione
Gli studenti dovrebbero guardare i link video forniti e tentare di rispondere alle domande nei loro appunti, il Q&A dovrebbe essere condotto dallo studente per accertare se gli studenti hanno capito i concetti prima di intraprendere l’attività.
Lavoro di squadra
Gli studenti lavoreranno in squadre per ricercare gli argomenti e preparare una presentazione per la classe su ciascuno degli esperimenti. Questa è un’estensione della base di conoscenza, dove gli studenti devono ricercare di più sulle inferenze fatte riguardo alle attività pratiche.
Rubriche
Includere una guida al punteggio per valutare la qualità delle risposte di valutazione degli studenti.
Attività
| Scala di lavoro indipendente | ||||||
| Zero | Un sacco di aiuto | Semi | Completamente | |||
| Indipendenza | con alcuni | Indipendente | Indipendente | |||
| Indipendenza | ||||||
| L’insegnante dà | L’insegnante dà | L’insegnante | Gli studenti | |||
| agli studenti un | agli studenti uno | specifica il | scelgono il | |||
| metodo completo con istruzioni chiare per come eseguire gli esperimenti. | schema per la procedura ma permette Opzioni* in diversi momenti. | composto e la concentrazione della soluzione.
Gli student ricercano il metodo da |
chimico e la concentrazione da realizzare. Gli student ricercano i metodi per la |
|||
| L’insegnante dà agli studenti uno schema per la procedura per | adottare per la preparazione dell’esperimento. | realizzazione dell’esperimento, ne scelgono uno, insieme ai | ||||
| realizzare gli | ||||||
| esperimenti, ma | ||||||
| con alcune | ||||||
| opzioni nella tecnica e nell’attrezzatura. | Gli studenti ricercano metodi per realizzare gli esperimenti utilizzando l’attrezzatura fornita. | chimici e le attrezzature da utilizzare. | |||||
| Osservazione e valutazione delle competenze | |||||||
| Seguire le procedure scritte e orali | Gli studenti seguono istruzioni scritte e orali | Gli studenti seguono istruzioni scritte e orali, facendo scelte individuali nella tecnica o nell’attrezzatura. | Gli studenti seguono un metodo che hanno studiato | Gli studenti seguono un metodo che hanno studiato | |||
| Utilizza in modo sicuro una serie di attrezzature e materiali pratici | Gli studenti devono usare l’attrezzatura in modo sicuro. | Gli studenti devono usare l’attrezzatura in modo sicuro. | Gli studenti riducono al minimo i rischi con un suggerimento minimo. | Gli studenti devono effettuare una valutazione completa dei rischi e minimizzare i rischi. | |||
| Applicare approcci e metodi investigativi quando si usano strumenti e attrezzature | Gli studenti devono usare correttamente l’attrezzatura appropriata.
La procedura dovrebbe essere seguita metodicamente e le variabili appropriate misurate o controllate. |
Gli studenti devono usare correttamente l’attrezzatura appropriata.
La procedura deve essere seguita metodicamente e le variabili adatte devono essere identificate, misurate e controllate. |
Gli studenti devono selezionare e utilizzare correttamente l’attrezzatura appropriata.
I passi procedurali devono essere ben sequenziati e regolati se necessario. Variabili adatte identificate, misurate e controllate. |
Lo studente deve scegliere un approccio metodico, attrezzature e tecniche appropriate. Le fasi procedurali devono essere ben sequenziate e regolate se necessario.
Le variabili adatte dovrebbero essere identificate per misurazione |
|||
| e controllo. Laddove le variabili non possono essere facilmente controllate, gli approcci dovrebbero essere pianificati per tenerne conto. | |||||||
| Fare e registrare le osservazioni | Gli studenti registrano i dati in modi specifici. | Gli studenti registrano dati accurati in modi specifici. | Gli studenti registrano dati precisi e accurati, usando metodicamente unità appropriate, in modi specifici. | Gli studenti devono scegliere il modo più efficace per registrare dati precisi e accurati in modo metodico usando unità appropriate. | |||
| Ricerche, riferimenti e rapporti | Si riportano i dati e si traggono le conclusioni.
Gli studenti realizzano presentazioni sulle attività pratiche con molte indicazioni. |
Si riportano i dati e si traggono le conclusioni.
Gli studenti confrontano i risultati e identificano le ragioni delle differenze. Gli studenti realizzano presentazioni sulle attività pratiche con qualche guida. |
Gli studenti devono ricercare i metodi disponibili.
Confrontano i risultati e riportano le differenze. Si usa un software appropriato per elaborare i dati e riferire i risultati. Gli studenti realizzano presentazioni sulle attività pratiche con un aiuto minimo dell’insegnante. |
Gli studenti devono ricercare delle alternative per pianificare il loro lavoro.
Il reporting riguarda la pianificazione, lo svolgimento e l’analisi dei loro risultati. Si usano software e/o strumenti appropriati per elaborare i dati e riferire i risultati. Gli studenti portano fuori le presentazioni sul pratico |
|||
| attività senza l’aiuto dell’insegnante. |
Allegato
Allegato II.
Prova il tuo modello di idea
| Testare il tuo organizzatore di idee | |
| 1. Domanda investigativa
La tua domanda dovrebbe mettere in relazione la variabile manipolata con la variabile rispondente. |
Domanda investigativa: Come sono fatti i giochi, da quali parti è composto un gioco? |
| 2. Ipotesi
La tua ipotesi dovrebbe essere scritta come un “SE, ALLORA, PERCHE’”. dichiarazione. |
|
| 3. Variabili
● Variabile manipolata (cosa cambierete) ● Variabile rispondente (cosa misurerete) ● Variabili controllate (cosa rimangono costanti per tutta la durata del test) |
|
| 4. Materiali
Crea una lista di tutti i materiali di cui hai bisogno. |
|
| 5. Procedura
Dovrebbe includere… ● Variabile manipolata |
|
| ● Variabile rispondente
● Variabili controllate ● Passi logici e ripetibili ● Registrazione di dati specifici ● Prove ripetute |
|
| 6. Dati
● Progetta una tabella per organizzare i dati che raccoglierai durante il tuo test. ● Usa la tua procedura per raccogliere e registrare i dati. ● Mostra i tuoi dati usando grafici e/o tabelle appropriate. |
|
| 7. Conclusione
● Indicate la vostra conclusione che mette in relazione la variabile manipolata con la variabile rispondente. ● Usa i dati per giustificare la tua conclusione. ● Dichiarate se la vostra ipotesi può essere accettata o rifiutata sulla base dei dati osservati. |
|
| 8. Analisi
● Discutete le potenziali fonti di errore e la potenziale influenza sui vostri risultati.
● Fornire idee su come e perché il disegno sperimentale potrebbe essere migliorato.
● Descrivere dati sorprendenti.
● Elenca le idee per rivedere la tua idea di test o nuove idee correlate da testare. |
|
| 9. Presenta i tuoi risultati alla tua classe. |
|
Allegato III.
Test della fiamma
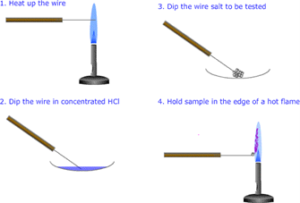
Procedura:
Per effettuare una prova di fiamma:
- Immergere un anello di filo pulito in un campione solido del composto da testare
- Mettere l’anello nel bordo della fiamma blu di un becco di Bunsen
- Osservare e registrare il colore della fiamma prodotta
- Lavare l’anello di filo in acido cloridrico diluito tra l’inoculazione con il sale metallico.
La tabella mostra i colori del test alla fiamma per sei ioni metallici comuni.
| Ione presente | Colore della prova della fiamma |
| Litio, Li+ | Rosso |
| Sodio, Na+ | Giallo |
| Potassio, K+ | Lilla |
| Calcio, Ca2+ | Arancione-rosso |
| Bario, Ba2+ | Verde |
| Rame, Cu2+ | Blu-verde |
Sicurezza
Vedere i materiali del piano di lezione.
Allegato IV.
La reattività dei metalli del gruppo 2
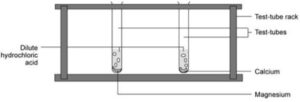
Procedura:
- Riempi due provette per un quarto con acido cloridrico diluito.
- In una provetta fai cadere un piccolo pezzo di magnesio.
- Nell’altro, lasciate cadere un piccolo pezzo di calcio.
- Confronta la reattività dei due metalli.
- Fai cadere un altro po’ di magnesio nella prima provetta e metti il pollice sull’estremità.
- Quando la pressione può essere sentita, togli il pollice e prova il gas con una stecca accesa.
- Registra quello che succede.
Sicurezza
Vedere i materiali del piano di lezione.
Allegato V.
Preparazione del cloruro di calcio

Procedura:
Per preparare il cloruro di calcio, dobbiamo seguire i passi elencati qui sotto:
- Prendete un becher e metteteci dentro il calcare indossando i guanti fino a riempire il becher di un quarto del suo volume totale.
- Ora, aggiungere HCl (acido cloridrico) a 1/4 di bicchiere circa al calcare
- Man mano che l’acido cloridrico dissolve il calcare, inizia a generare bolle. Ora mescola delicatamente il contenuto del becher e fai attenzione che la reazione si completi. Se tutto il calcare si dissolve, aggiungi un po’ di calcare.
- Poi, filtrare i solidi versando la soluzione attraverso la carta da filtro non appena la soluzione smette di gorgogliare.
- Ora, riscaldate il secondo becher, che ha una soluzione di cloruro di calcio. Il cloruro di calcio solido è quello che rimane dopo l’evaporazione dell’acqua.
Sicurezza
Vedere i materiali del piano di lezione.
Allegato VI.
Procedura per lo spostamento degli alogeni
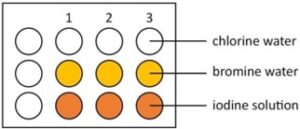
- Prendete un vassoio di reazione ed etichettate le righe, Cl2, Br2, I2 e le colonne H2O, NaCl, NaBr, NaI usando un pennarello non permanente o mettendo il vassoio di reazione sopra un pezzo di
carta. In alternativa, questo esperimento potrebbe essere eseguito su una copia laminata delle istruzioni integrate.
- Usando il flacone contagocce, aggiungi 3-4 gocce di acqua clorata ad ogni pozzetto della prima fila.
- Usando il flacone contagocce aggiungete 3-4 gocce di acqua di bromo ad ogni pozzetto della seconda fila.
- Usando il flacone contagocce, aggiungere 3-4 gocce della soluzione di iodio ad ogni pozzetto della terza fila.
- Annota i colori di ogni soluzione.
- Aggiungere 3-4 gocce di acqua distillata ad ogni pozzetto della colonna 1.
- Aggiungere 3-4 gocce di soluzione di cloruro di sodio a ciascuno dei tre pozzetti della colonna 2 della piastrella.
- Aggiungere 3-4 gocce di soluzione di bromuro di sodio a ciascuno dei tre pozzetti della colonna 3 della piastrella.
- Aggiungere 3-4 gocce di soluzione di ioduro di sodio a ciascuno dei tre pozzetti della colonna 4 della piastrella
- Osservare e registrare i cambiamenti di colore che avvengono in ogni fila confrontando il primo pozzetto con gli altri della fila.
Sicurezza
Vedere i materiali del piano di lezione.
Aggiunta di una soluzione di nitrato d’argento acidificato per distinguere tra cloruro, bromuro e ioduro (seguita dall’aggiunta di una soluzione di ammoniaca diluita e concentrata)
Test per gli ioni alogenuri in soluzione acquosa. Test per gli ioni cloruro, bromuro e ioduro in soluzione acquosa Questo test deve essere fatto in soluzione. Se si parte da un solido, questo deve prima essere sciolto in acqua pura.
La soluzione viene acidificata aggiungendo acido nitrico diluito. (Ricorda: nitrato d’argento + acido nitrico diluito).
L’acido nitrico reagisce con, e rimuove, altri ioni che potrebbero anche dare un precipitato confuso con il nitrato d’argento.
Procedura:
- Ad un piccolo volume di ciascuna delle soluzioni di cloruro di potassio, bromuro di potassio e ioduro di potassio in tre provette separate, aggiungi un volume uguale di acido nitrico diluito seguito da circa 2 cm3 di soluzione di nitrato di argento.
- Registra le tue osservazioni.
- Ruotare le provette per assicurarsi che i precipitati formati in ogni caso siano distribuiti uniformemente e poi dividere il contenuto di ogni provetta a metà.
- Ad una metà del contenuto, aggiungete un eccesso di soluzione acquosa diluita di ammoniaca e osservate cosa Registra le tue osservazioni.
- All’altra metà, e lavorando in una cappa, aggiungete un eccesso di soluzione concentrata di ammoniaca e osservate cosa succede. Registra le tue osservazioni.
Viene poi aggiunta una soluzione di nitrato d’argento per dare:
| ione presente | osservazione |
| F- | |
| Cl- | |
| Br- | |
| I- |
Sicurezza
Vedere i materiali del piano di lezione.

